高校有機化学において、特に受験される方において必須のテクニック “不飽和度”。主に有機化合物の構造決定に重要になります。今回の記事で詳しく解説します。
そもそも不飽和度とは?
不飽和度(Degree of unsaturation)または水素不足指数(すいそふそくしすう、Index of hydrogen deficiency、IHD)とは、ある有機化合物の水素原子がどの程度不足しているかを表す指標です。
この不飽和度を計算することで、その有機化合物にどんな構造が含まれているのか(二重結合、三重結合、ベンゼン環など)、推定することが可能になります。
不飽和度の計算式

- C:炭素原子の数
- N:窒素原子の数
- X:ハロゲン原子(F, Cl, Br, I)の数
- H:水素原子の数
この式は是非暗記してください。不飽和度の式は見る参考書によって異なります。(ハロゲンなどを考慮していないものもあるので)上記の式で覚えてしまえば、まず問題ないでしょう。
この式を暗記しておくと、次のことがわかるようになります。👇
- 不飽和度=0の場合:全て単結合から構成されている
- 不飽和度=1の場合:二重結合、あるいは環状の炭化水素が1つ含まれている
- 不飽和度=2の場合:三重結合、あるいは二重結合が2つ、あるいは環状の炭化水素+二重結合が1つ(不飽和度1が2つと考える)
- 不飽和度=4の場合:ベンゼン環を含む(ことが多い)(二重結合×3と環状×1の合計だと考える)
例題で確認しよう!
C4H10
\begin{eqnarray}
不飽和度=\frac{(2×4+2-10)}{2}=0
\end{eqnarray}
つまり不飽和度0より全て単結合で構成されていますね。いわゆるブタンですね。
C5H10O
\begin{eqnarray}
不飽和度=\frac{(2×5+2-10)}{2}=1
\end{eqnarray}
ちなみにこの構造異性体はたくさんあります。ここでは不飽和度の計算練習として出してみました。不飽和度が1なので二重結合、あるいは環状の炭化水素が1つ含まれているということが分かりますね。
練習問題で不飽和度をマスター!
次の化合物の不飽和度を求めよ。(東京農工大)
(1)シクロヘキサン
(2)酢酸
(3)菊酸(C10H16O2)
(1)シクロヘキサンの分子式はC6H12であるので、不飽和度は
\begin{eqnarray}
不飽和度=\frac{(2×6+2-12)}{2}=1
\end{eqnarray}
(2)酢酸の分子式はC2H4O2であるので、不飽和度は
\begin{eqnarray}
不飽和度=\frac{(2×2+2-4)}{2}=1
\end{eqnarray}
(3)菊酸の分子式はC10H16O2であるので、不飽和度は
\begin{eqnarray}
不飽和度=\frac{(2×10+2-16)}{2}=3
\end{eqnarray}
C2H4Oの構造異性体を全て書きなさい。
炭素原子の数2つ、水素原子の数4つ、酸素原子の数が1つなので
\begin{eqnarray}
不飽和度=\frac{(2×2+2-4)}{2}=1
\end{eqnarray}
であるので、可能性として、二重結合、あるいは環状の炭水化物が1つ含まれていると推測できる。
ここから原子の種類と数に注意すると、構造異性体は次の3つに絞られる。
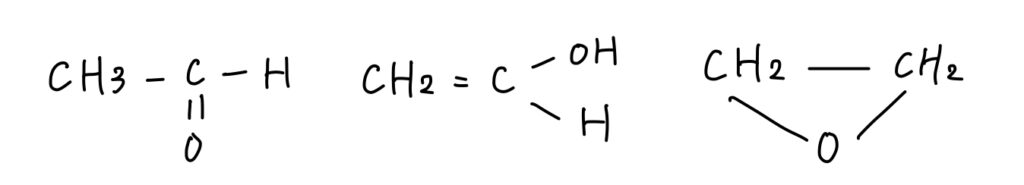
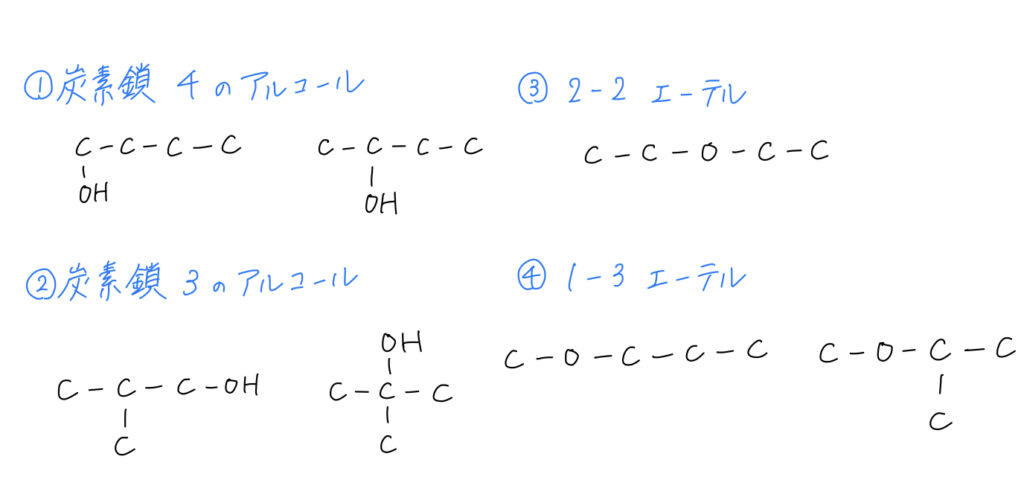
C4H10Oの構造異性体を全て書きなさい。
炭素原子の数 4つ、水素原子の数10、酸素原子の数が1つなので
\begin{eqnarray}
不飽和度=\frac{(2×4+2-10)}{2}=0
\end{eqnarray}
であるので、全て単結合であると分かる。つまり二重結合がないので、ケトンやアルデヒドの可能性を消すことができた。ここから原子の種類と数に注意すると、アルコールもしくはエーテルだと分かり、構造異性体は次の7つに絞られる。
鎖状の脂肪酸C17H29COOHには炭素原子間の二重結合が何個含まれているか。

「脂肪酸」がよく分からない方は、ぜひそちらも併せて調べてみましょう!
C17H29COOH、つまりC18H30O2であるので、
\begin{eqnarray}
不飽和度=\frac{(2×4+2-10)}{2}=4
\end{eqnarray}
である。カルボキシ基には二重結合がすでに1つあるので、炭素原子間での二重結合は3つある。



C17H29COOHはリノレン酸で、二重結合が3つということは是非覚えておくといいです!
明治大学 2022年 理工学部の問題(一部改変)
分子式がC6HyOzで表される5員環の環状構造をもつ有機化合物A,B,C,Dを出発原料に用いて以下の実験を行った。
1) A,B,C,Dをそれぞれ50mg測りとり、酸素気流下において完全燃焼させたところ、いずれの場合も132mgの二酸化炭素と54mgの水が生じた。
2) A,B,C,Dそれぞれのジエチルエーテル溶液に金属ナトリウムを加えたところ、Cを含む溶液以外からは水素が発生した。
問題:(a) 記述1)に基づけば、有機化合物Bが持つ水素化合物の数 (y)と酸素原子の数 (z)は何になるか。
(b) 問題の説明文と各実験の結果に基づいて考えると、Cの構造の候補としては最大で【 】個考えられる。(立体異性体は区別しない)また、その中で不斉炭素原子が含まれる構造は【 】個ある。
(a)解答解説はこちら!
(a)まず、元素分析を行います。C,H,Oの質量を求めてみましょう。
\begin{eqnarray}
C:132×\frac{12}{44}=36mg \\
H:54×\frac{2}{18}=6.0mg \\
O:50-(36+6.0)=8mg
\end{eqnarray}
次にそれぞれの物質量の比を求めます。
\begin{eqnarray}
C:H:O = \frac{36}{12}:\frac{6.0}{1.0}:\frac{8}{16}=6:12:1
\end{eqnarray}
よって、分子式が(C6H12O)nとわかります。問題文から、炭素数は6なのでn=1、つまり分子式はC6H12Oと言えます。以上より解答は、y=12, z=1です。
(b)解答解説はこちら!
具体的な構造を考えるときは、不飽和度の出番です。計算してみましょう。
\begin{eqnarray}
不飽和度=\frac{(2×6+2-12)}{2}=1
\end{eqnarray}
不飽和度が1ということですが、問題文から既に5員環があることが判明しているので、ここで不飽和度を消費しています。つまりそれ以外に二重結合・三重結合は存在しません。ケトンやアルデヒドの可能性もないわけですから、この化合物はアルコールorエーテルだと確定できますね。
また問題文2)より、アルコールではないと分かります。なぜなら金属ナトリウムを加えた際に水素が発生するのは、エーテルではなくアルコールの性質だからです。
以上から構造を考えてみましょう。まずは炭素で5員環を作った場合、以下の化合物が考えられます。

また、酸素原子が5員環の中に入るパターンがあります。書き出してみましょう。
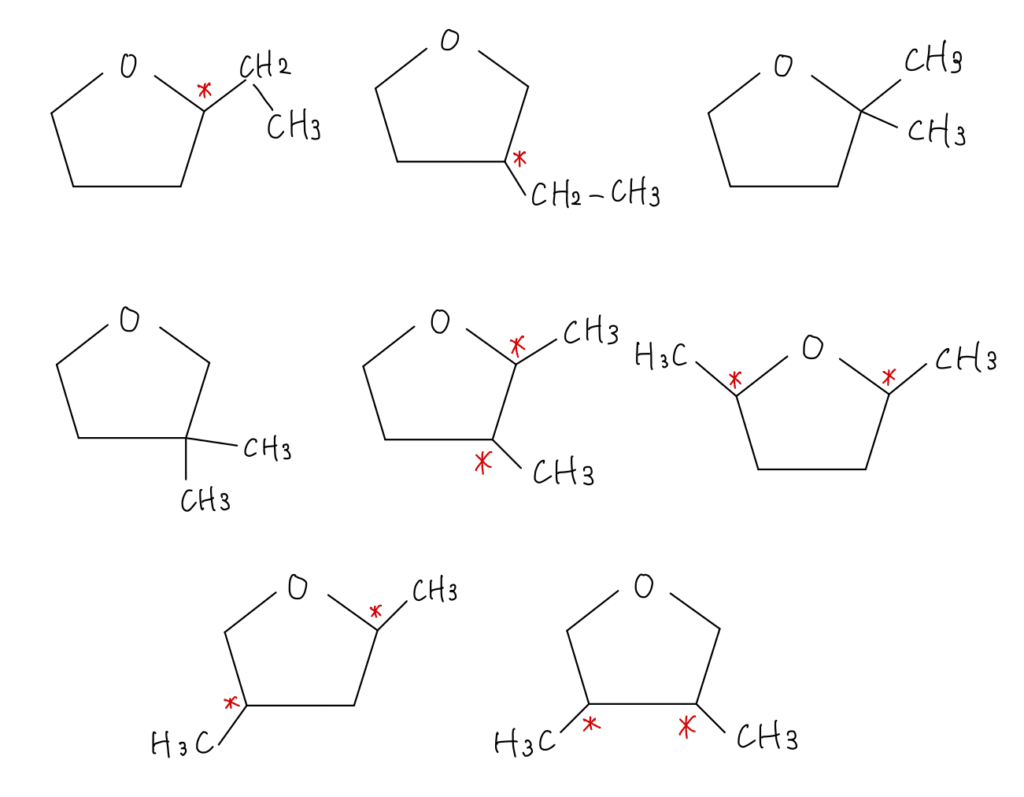

以上の9通りあります。また不斉炭素原子を含む化合物は6つあると分かりました。
何に不飽和度は役立つのか?
筆者の経験上、不飽和度はやはり有機化合物の構造決定の際に輝きます。例えば加水分解して、化合物が2つに分かれた際に、不飽和度を計算します。これが仮に6になった場合は、ベンゼン環で4使うので、残り二重結合が2つかなと検討をつけることができます。
分子式が判明したら、不飽和度を計算する癖をつけてみるのはいかがでしょうか。
今回はここまでです!ありがとうございました。




















コメント