化学を学んでいる大学生の方が最初に悩みやすい「電子配置」「パウリの排他原理」「フントの規則」という大事なルール。この規則は、原子の中の電子がどうやって配置されるかを教えてくれるものです。重要な規則なのですが、最初は難しく感じます。筆者も苦労しましたが、今回の記事では具体例を使ってわかりやすく説明していきますね。

高校化学を超えた、発展的な内容を学びたいという高校生の方にもおすすめの記事です!順を追って説明していきますね!
電子軌道を理解しよう!
まずは高校化学の復習から!
高校化学で、電子殻について学習したことを覚えていますでしょうか。高校の時に習った内容を簡単にまとめると
- 電子殻は、内側から順にK殻、L殻、M殻、N殻…という名前がついている
- それぞれの殻に入る最大の電子数は順に、2、8、18、32…となる。(2n2という式でまとめられる)
ここでは、「それぞれの殻のなかに何個の電子が入るのか」ということしか言及されていませんでした。しかしこれから登場する「電子軌道」という考え方を用いることで、電子がどこに存在していそうか、という議論をすることができます。



正確にいうと、位置と運動量を同じタイミングで正確に測定することはできないので、代わりに電子が存在する確率の分布を考えています。
電子軌道とは?
電子は、どこに存在しているかを正確に特定することができません。そこで、電子が存在してそうな場所を数学的に明らかにしました。それがs軌道,p軌道,d軌道,f軌道…というものです。
この軌道の大きなルールを以下にまとめます。
- 軌道の数はそれぞれ奇数個で、増えていく(s軌道は1個ある。p軌道は3個ある。d軌道は5個ある…という流れ)。
- 1つの軌道には、2つしか電子が入らない!
これらのルールに則ると、高校化学の「殻」と「軌道」は以下のようにリンクしますね。
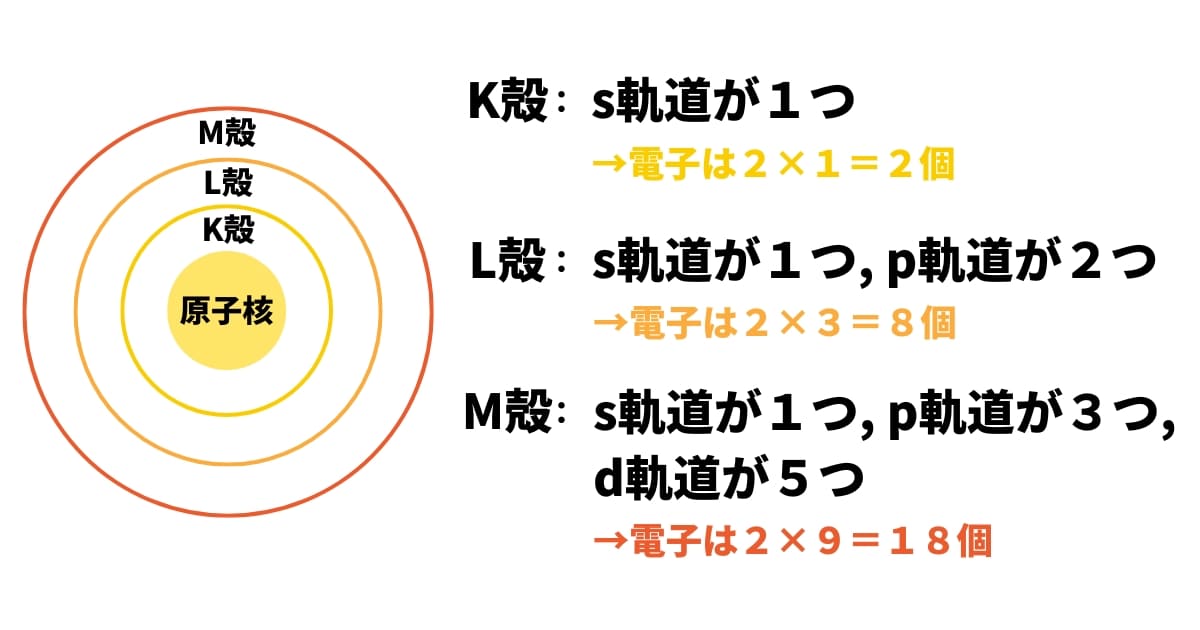




ここでは詳しくは省略しますが、それぞれの軌道には「方向性」があります。例えばp軌道であれば、px軌道、py軌道、pz軌道という3種類があって、それぞれに最大2個まで電子が入ります。s軌道には方向性はありません。
どういう順番で電子は収容されていく?
s,p,d…軌道にそれぞれ2つずつ電子は入っていくことは分かりましたが、ではどういう順番で入っていくのかを次にご紹介します。これは分かりやすい図があるので、参考にしてください。
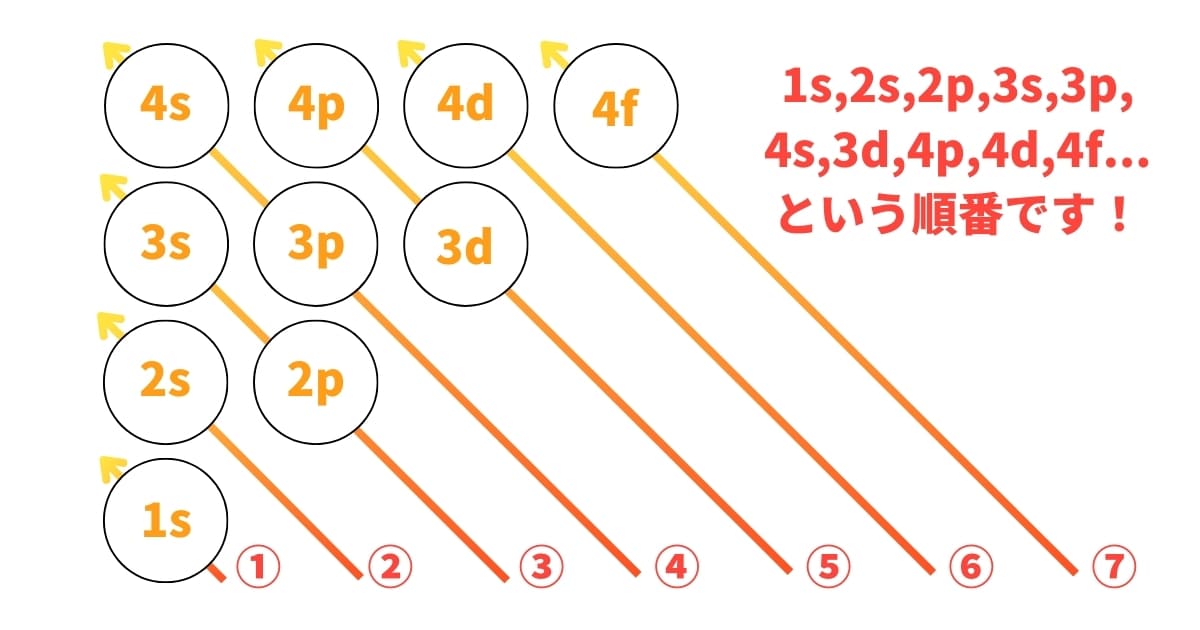

上記の図のように、①から順番に左斜め上に見ていきます。するとそれが電子が入っていく順番になっています。具体的には、1s,2s,2p,3s,3p,4s,3d,4p,4d,4f…という順番になっていますね。



ここで気づいて欲しい点は、3dよりも4sの方が優先度が高いということです。数字は必ずしも優先度を表しているということではないんですね。
ではちょっと具体例で練習してみましょう。
- 軌道の数はそれぞれ奇数個で、増えていく(s軌道は1個ある。p軌道は3個ある。d軌道は5個ある…という流れ)。
- 1つの軌道には、2つしか電子が入らない!
- 軌道は、1s,2s,2p,3s,3p,4s,3d,4p,4d,4f…という順番
解答と考え方はこちらをタップ(クリック)!
〈解答と考え方〉
18Arには、電子が18個存在しています。ポイントを元にして考えます。
s軌道には電子が2個、p軌道は6個、d軌道は10個まで電子が入ります。また、軌道の順番にも注意すると
1sに2個、2sに2個、2pに6個、3sに2個、3pに6個となります。これを機に正式な書き方も覚えておきましょう。右上に入る電子の数を書いて以下のように表現します。
1s2 2s2 2p6 3s2 3p6
確かに右上の数を全部足すと、18になっていますよね。
解答と考え方はこちらをタップ(クリック)!
〈解答と考え方〉
34Seには、電子が34個存在しています。ポイントを元にして考えます。
s軌道には電子が2個、p軌道は6個、d軌道は10個まで電子が入ります。また、軌道の順番にも注意すると
1sに2個、2sに2個、2pに6個、3sに2個、3pに6個、3dに10個、4sに2個、4pに4個となります。つまり
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
となります。確かに右上の数を全部足すと、34になっていますよね。
ここまで理解できたでしょうか。次に「電子のスピン」をご紹介しますね。
電子のスピンを理解しよう!
多くの実験から、電子はまるで自転しているかのような性質を持っていることが分かりました。詳しくは省略しますが、電子には、上向き(アップスピン)と下向き(ダウンスピン)の2つの状態があることを覚えておいてください。
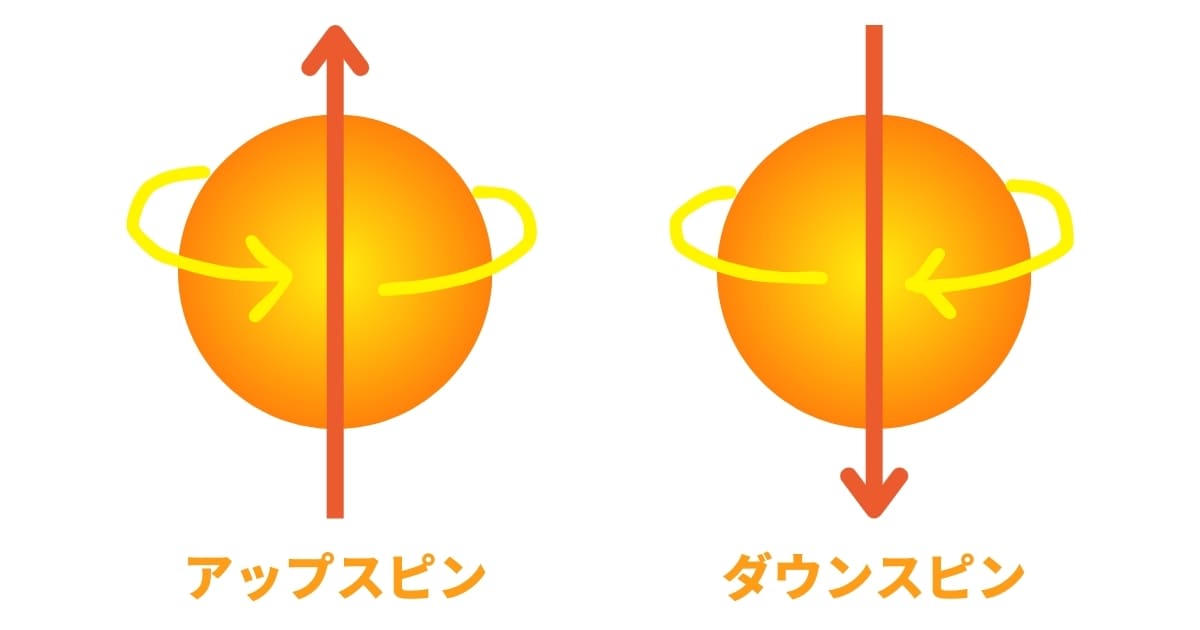




電子が回っている、というのはあくまでこれはイメージなので実際に回っているわけではないです。
電子のスピンはこれくらいで大丈夫です。次に「パウリの排他原理(パウリの排他律)」をご紹介します。ここで離脱する方が多いですが、頑張って読んでみてください!
パウリの排他原理(パウリの排他律)を理解しよう!
パウリの排他原理は分かりやすく一言で表すと、
同じ原子内の同じ軌道(エネルギー準位)にある2つの電子は、同じスピン状態(量子状態)を持つことができない。
という規則のことです。もう少し噛み砕いて言うと、同じ軌道に2つの電子が入る場合、必ずスピンが逆向きでなければならないということです。
例えば、ヘリウム原子(He)は2つの電子を持っていますね。先ほど、1つの軌道には、2つしか電子が入らないと説明しましたが、ヘリウムの電子はパウリの排他原理に従うと、2つの電子は次のように配置されます。
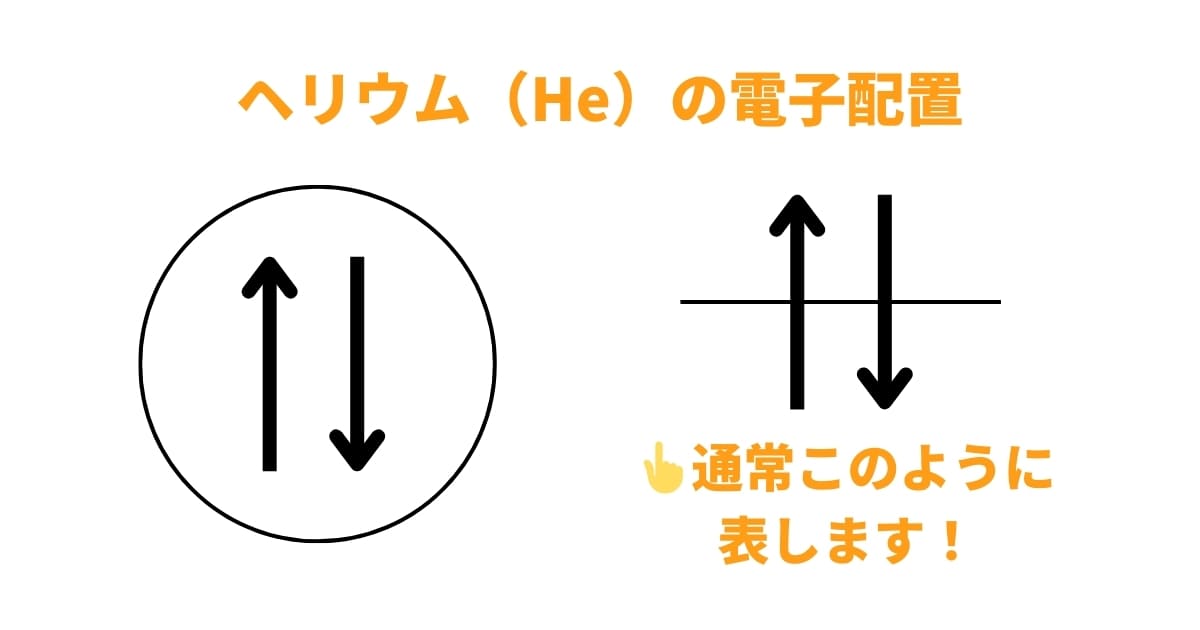




このように、↑(アップスピン)と↓(ダウンスピン)の電子が1つずつ配置されます。↑↑や↓↓という組み合わせはあり得ないというわけです。
ここまでいかがでしょうか。 1つの軌道には、2つの異なるスピン状態電子が入るということを理解していただけたと思います。これでどんな原子でも、電子配置が書ける…と思いきや、もう1つの超重要なルールがあります。
それが「フントの規則」です。以下にご紹介します。
フントの規則を理解しよう!
フントの規則も分かりやすく一言で表すと、
複数個の軌道があるときは、まずは別々の軌道に、スピンの向きをそろえて入っていく
という規則のことです。ドイツの物理学者フリードリッヒ・フントが発見したものなのですが、これだけだと分かりにくいので、具体例を出して説明します。
炭素原子の電子配置を考えよう
ここでは、炭素原子(C)の電子配置を考えます。炭素原子は6個の電子を持っていますね。よってこれまでのことを踏まえると以下のように考えてしまいたくなります。
-1-e1722073059525.jpg)
-1-e1722073059525.jpg)
しかしここで「フントの規則」を思い出してください。まずは別々の軌道に、スピンの向きをそろえて入っていきます。ですので、p軌道は以下のようになるんです。
-1.jpg)
-1.jpg)
規則を分かっていただけましたでしょうか。最後に練習問題を解いてみてください!
練習問題②の答えも参考にしながら、実際にスピンを書いてみましょう!
〈解答と考え方〉
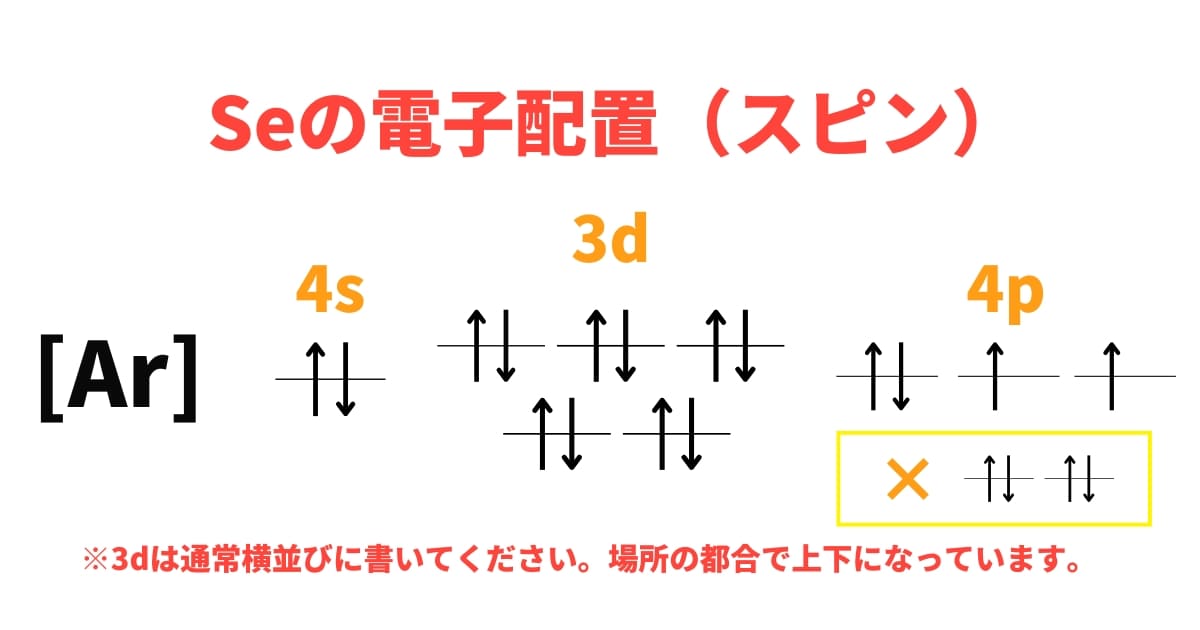
34Seは、練習問題②より、1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4となることが分かりましたね。
ここで1つ思うことが、



「34本も矢印書くの?」
ということですよね。しかしそこは安心してください。希ガスの電子配置を書くことで省略することが許されています。
今回の問題であるSeでいうと、その前に登場する希ガスであるAr(アルゴン)の電子配置を借りてこのように書いてOKです。
[Ar] 3d10 4s2 4p4 という表記でOK!
さらに実際にスピンを書く際も、すべて矢印を書く必要はなく、[Ar]としておいて、その後から書けばOKです。実際に書いてみましょう。

まとめ
いかがでしたでしょうか。「電子配置」「パウリの排他原理」「フントの規則」は、化学で学ぶ重要な概念です。電子がどのように配置されるかを理解することで、原子や分子の安定性、スペクトルの解釈、化学結合の理解が深まります。具体例を通じて、ぜひこの規則を覚えて、化学の世界をさらに楽しんでください!
ここまで読んでいただきありがとうございました!












コメント